En los átomos polielectrónicos, los protones que se encuentran en el núcleo no ejercen la misma fuerza de atracción sobre todos los electrones por igual. Esto se debe a los efectos pantalla que causan los electrones más cercanos al núcleo sobre los que se encuentran más alejados. Se le llama carga nuclear efectiva a la diferencia entre la carga nuclear neta (que depende del número atómico del elemento) y la constante del efecto pantalla s, es la fuerza real que ejerce el núcleo sobre un electrón en particular.
Z es el número de protones y electrones del átomo, dado por su número atómico, y s el valor de la constante de apantallamiento, que depende del número de electrones que separan al núcleo del electrón en cuestión, y también depende de los orbitales atómicos en que se hallen los electrones que causan el efecto pantalla.
También influyen en este efecto los electrones que se encuentran en el mismo nivel de energía que el electrón considerado. No tienen influencia en esta constante los electrones que se hallan en niveles de energía.
Z es el número de protones y electrones del átomo, dado por su número atómico, y s el valor de la constante de apantallamiento, que depende del número de electrones que separan al núcleo del electrón en cuestión, y también depende de los orbitales atómicos en que se hallen los electrones que causan el efecto pantalla.
También influyen en este efecto los electrones que se encuentran en el mismo nivel de energía que el electrón considerado. No tienen influencia en esta constante los electrones que se hallan en niveles de energía.
¿CÓMO CALCULAR LA CARGA EFECTIVA NUCLEAR?
La carga nuclear efectiva puede calcularse según las reglas de Slater, quien las formuló en 1930:
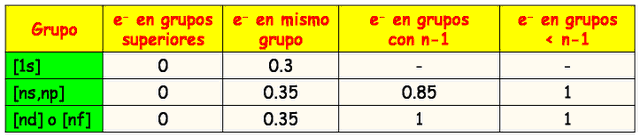
- Los electrones ubicados en un orbital de mayor nivel contribuyen en 0 (para la sumatoria que da como resultado la constante de apantallamiento s)
- Cada electrón en el mismo nivel contribuye en 0,35.(excepto si el nivel es 1s, que resta 0,30).
- Electrones en el nivel inmediato inferior, si están en orbitales s o p contribuyen en 0,85, si son de orbitales d o f contribuyen en 1,0 cada uno.
- Electrones por debajo del nivel inmediato inferior, contribuyen en 1,0 cada uno.

Entonces, para calcular la carga nuclear efectiva, primero, situamos los electrones del átomo en sus orbitales atómicos:
1s, 2s,2p, 3s,3p,3d,4s,4p, 4d, 4f, etc.
Luego, para el cálculo de la carga nuclear efectiva sobre un electrón determinado, debemos calcular s y para ello tomamos en consideración los electrones que se encuentran en niveles de energía inferiores o iguales, que son los que causan apantallamiento del mismo, como indica la tabla de arriba, según las reglas de Slater.
Entonces, por ejemplo para calcular la carga nuclear efectiva sobre un electrón 4s del átomo de Zinc (número atómico 30), primero debemos ubicar los electrones en los orbitales atómicos correspondientes:
1s2 2s2 2p6 3s2 3p6 3d10 4s2
Luego calcular el valor que cada electrón del mismo nivel y de niveles inferiores va a restar a la carga nuclear total, esto es, según la tabla de arriba:
1 electrón en el nivel 4s..…………………..resta 0,35.
8 electrones en el nivel 3 s y 3 p ………..restan 0,85 cada uno.
10 electrones en el nivel 3d..……………..restan 1,0 cada uno.
8 electrones en el nivel 2 s y 2 p.…………restan 1,0 cada uno.
2 electrones en el nivel 1s…………………..restan 1,0 cada uno.
Entonces calculamos s:
s= (1 . 0,35) + (20 . 1) + (8 . 0,85)=27,15
La carga nuclear efectiva para un electrón del orbital 4s de Zinc sería
Z ef= 30 – 27,15= 2,85
Este cálculo se sencillo, aunque no es exacto, dado que Slater consideró los electrones de orbitales s y p con el mismo valor, lo que no es exactamente así.
Ponte cómodo y tómate el tiempo de practicar estos ejercicios de este vídeo, para que aprendas fácilmente a calcular la carga efectiva nuclear, e ir preparado para tratar en tema con tu profesor en la clase.
Comentarios
Publicar un comentario