Dos de las propiedades que causan confusión, por el nombre similar y porque significan cosas similares también, son la electronegatividad y la electroafinidad. Para evitar esto, aquí se analizarán estas propiedades que son muy importantes para la Química (sobre todo la electronegatividad).
Electronegatividad: Es una de las propiedades más importantes para la química, ya que es esta propiedad la que explica el tipo de enlace químico en un compuesto y las propiedades de reacción de éstos. La electronegatividad se puede definir como capacidad que tiene un elemento para atraer electrones o densidad electrónica cuando forma un enlace. El concepto de densidad electrónica hace referencia a la nube electrónica que abarca a todo el compuesto (se verá en la sección correspondiente a enlace químico). Esta propiedad obtiene valores arbitrarios, siendo los más famosos los de Pauling, el cual tomó al Flúor (el elemento más electronegativo) como referencia (otorgándole un valor de 4.0). La electronegatividad aumenta a medida que se avanza en un periodo y que disminuye a medida que se baja en un grupo, tal y como se ve en la Imagen PPE-1.
Imagen PPE-1: Direcciones de crecimiento de la electronegatividad en la Tabla Periódica.
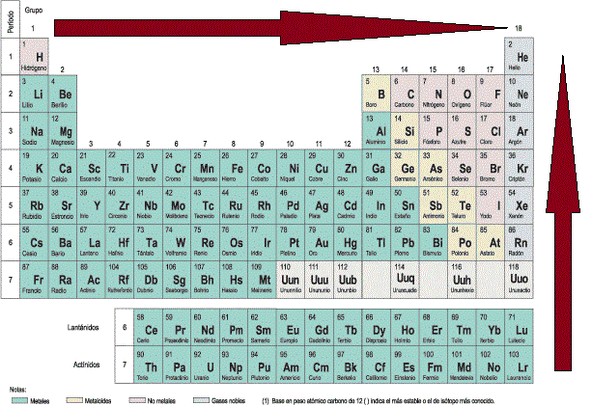
Electronegatividad: Es una de las propiedades más importantes para la química, ya que es esta propiedad la que explica el tipo de enlace químico en un compuesto y las propiedades de reacción de éstos. La electronegatividad se puede definir como capacidad que tiene un elemento para atraer electrones o densidad electrónica cuando forma un enlace. El concepto de densidad electrónica hace referencia a la nube electrónica que abarca a todo el compuesto (se verá en la sección correspondiente a enlace químico). Esta propiedad obtiene valores arbitrarios, siendo los más famosos los de Pauling, el cual tomó al Flúor (el elemento más electronegativo) como referencia (otorgándole un valor de 4.0). La electronegatividad aumenta a medida que se avanza en un periodo y que disminuye a medida que se baja en un grupo, tal y como se ve en la Imagen PPE-1.
Imagen PPE-1: Direcciones de crecimiento de la electronegatividad en la Tabla Periódica.

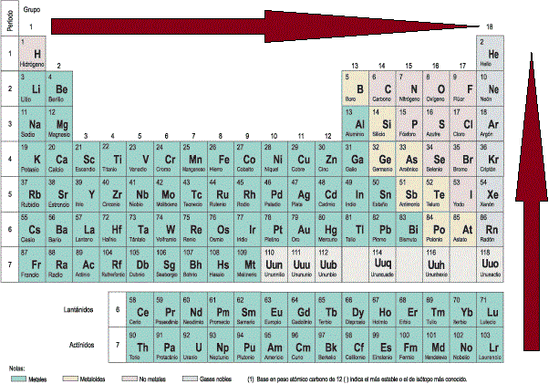
- Electroafinidad: También llamada afinidad electrónica, corresponde a la energía que libera un elemento cuando capta un electrón desde el infinito. Está definición hace referencia a la capacidad que tiene un elemento para poder captar electrones, por ende, los metales serán los que tengan una electroafinidad menor, los cuales se ubican a la izquierda de la tabla periódica, por lo tanto esta propiedad aumenta a medida que se avanza en el periodo y disminuye a medida que se baja en el grupo (Imagen PPE-2).
Imagen PPE-2: Direcciones hacia donde aumenta la afinidad electrónica.

Estudiantes, les dejamos dos vídeos (uno sobre la electroafinidad, y otro sobre la electronegatividad).
Les recordamos que la finalidad de esto es que lean el material y vean los videos colgados (haciendo resumenes de ellos) desde antes, para que estén preparados para debatir y hacer ejercicios en el aula con el profesor.
Les recordamos que la finalidad de esto es que lean el material y vean los videos colgados (haciendo resumenes de ellos) desde antes, para que estén preparados para debatir y hacer ejercicios en el aula con el profesor.
Comentarios
Publicar un comentario